Hier finden Sie Erklärungen zu verschiedenen Experimenten aus der Chemie und Physik. Detaillierte Beschreibungen der Versuche finden Sie im Experimentalheft des Schauvorlesungsteams.
Herstellen von Berliner Blau und Kunstblut (Geheimtinte)
Mit diesem sehr einfachen Experiment sind Komplexbildungsreaktionen des Eisens veranschaulichbar. Dabei treten Charge-Transfer-Farberscheinungen auf, wodurch geheime Botschaften geschrieben werden können, die ohne die richtige Lösung verborgen bleiben.
Auf das Filterpapier werden Eisen(III)-Ionen (Fe3+) aufgetragen, wobei keine Farbänderung auftritt. Werden dann Hexacyanidoferrat(II)-Ionen zugegeben, indem Kaliumhexacyanidoferrat(II)-Lösung aufgesprüht wird, bildet sich Eisen(III)-hexacyanidoferrat(II,III) (FeIII[FeIIFeIII(CN)6]3), auch bekannt als Berliner Blau, ein tiefblaues Pigment. Bei Verwendung von Kaliumthiocyanat (KSCN) bildet sich in der wässrigen Phase ein blutroter, oktaedrischer Komplex von [Fe(SCN)6]3–. Die Farben sind das Resultat sogenannter Charge-Transfer-Prozesse, die in Komplexen auftreten können, wenn diese durch Licht angeregt werden.
Reaktionsgleichungen:
4 Fe3+ + 3 [Fe(CN)6]4– → FeIII[FeIIFeIII(CN)6]3↓
Fe3+ + 6 SCN– → [Fe(SCN)6]3–
Blue Bottle
Mit diesem Experiment werden Eigenschaften von Redoxsystemen am Beispiel des organischen Farbstoffs Methylenblau veranschaulicht. Konjugierte Bindungssysteme, in denen sich Elektronen frei bewegen und angeregt werden können, sorgen für die Farberscheinungen. Durch Reduktion und Oxidation lässt sich die Struktur des Farbstoffs verändern. Dies hat eine Farbänderung zur Folge.
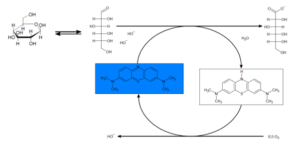
Das “Farbenspiel” in diesem Versuch wird durch den Farbstoff Methylenblau hervorgerufen. Dieser wird im alkalischen Milieu durch die Glucose zu farblosem Leukomethylenblau reduziert. Durch die Reduktion werden Doppelbindungen im Methylenblau-Molekül aufgebrochen, was zu einer Veränderung des π-Elektronen-Systems führt, wodurch sich die Farbe der Lösung ändert. Beim Schütteln diffundiert Luftsauerstoff in die Lösung und oxidiert das farblose Leukomethylenblau wieder zu blauem Methylenblau. Das Methylenblau kann dann erneut durch überschüssige Glucose reduziert werden. Das Redoxsystem besteht, solange Glucose als Elektronendonor und Sauerstoff als Elektronenakzeptor in der Lösung vorhanden sind. Wenn beim Schütteln also keine Blaufärbung mehr zu beobachten ist, sollte der Deckel der Schottflasche kurz geöffnet werden, so dass Luftsauerstoff in die Flasche eindringen kann.
Reaktionsgleichungen:
Nicht-newton’sches Fluid
Nicht-newton’sche Flüssigkeiten haben eine veränderliche Viskosität. Darunter versteht man, wie zäh eine Flüssigkeit ist, was wiederum mit den zwischenmolekularen Kräften zu tun hat. Im Extremfall führt ein hoher und ruckartig auftretender lokaler Druck dazu, dass sich diese Arten von Flüssigkeiten plötzlich wie Feststoffe verhalten. Bei herkömmlichen Flüssigkeiten ändert sich die Viskosität mit der Temperatur. Je wärmer es wird, desto flüssiger wird der Stoff.
Ein Beispiel einer nicht-newton’schen Flüssigkeit ist eine Mischung von Stärke und Wasser im Verhältnis 2:1. Der Grund für dieses Phänomen liegt vereinfacht darin, dass das Wasser zwischen den Speisestärketeilchen bei Druck verdrängt wird und diese sich dann ineinander verhaken. Lässt man die Finger jedoch langsam hindurch gleiten, wirkt das Wasser wie ein Schmiermittel. Das Gemisch verhält sich, wie eine Flüssigkeit.
Chemische Ampel
In diesem Experiment werden Eigenschaften von Redoxsystemen am Beispiel des organischen Farbstoffs Indigokarmin veranschaulicht. Konjugierte Bindungssysteme, in denen sich Elektronen frei bewegen und angeregt werden können, rufen die Farberscheinungen hervor. Durch Reduktion und Oxidation lässt sich die Struktur des Farbstoffs verändern. Dies hat eine Farbänderung zur Folge. In dem Versuch zeigen sich so alle Farben der Ampel.
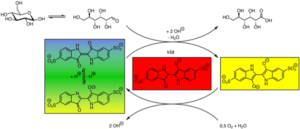
Das „Farbenspiel“ in diesem Versuch wird durch den Farbstoff Indigokarmin hervorgerufen. Im alkalischen Milieu wird Indigokarmin in zwei Stufen zu Leukoindigokarmin reduziert. Als Reduktionsmittel wirkt die Glucose. Durch die Reduktion werden zwei Doppelbindungen an Sauerstoffatomen des Indigokarmins aufgebrochen, was zu einer Veränderung des π-Elektronen-Systems führt, wodurch sich die Farbe der Lösung ändert. Zusätzlich beeinflusst der pH-Wert die Farbe des Indigokarmins. Indigokarmin ist blau, wird aber im basischen Milieu durch weitere Deprotonierung gelb. In der verwendeten Lösung liegen die Spezies im Gleichgewicht vor und die Lösung erscheint grün. Während der Reduktion durch die Glucose entstehen zunächst radikalische Zwischenstufen, die eine rote Farbe besitzen. Werden diese noch weiter reduziert, so enthält die Lösung Leukoindigocarmin, welches eine gelbe Farbe erzeugt. Zur besseren Nachvollziehbarkeit ist im unteren Mechanismus das Leukoindigocarmin als Tetraanion dargestellt und das Gluconat-Anion als Gluconsäure. In der Realität liegt die Glukonsäure bei dem vorhandenen pH-Wert deprotoniert vor, während eine Hydroxygruppe am Leukoindigocarmin-Tetraanion protoniert wird, sodass hier ein Trianion vorliegt. Durch Sauerstoff aus der Luft wird beim Schütteln das Leukoindigocarmin wieder oxidiert und die Ampel schlägt von gelb über rot zurück nach grün um, die Farbe des Indigokarmins beim vorliegenden pH-Wert. Das Redoxsystem besteht, solange Glucose als Elektronendonor in der Lösung vorhanden ist.
Reaktionsgleichungen:
Das Leuchten der Elemente: III-V-Halbleiter LEDs
III-V-Halbleiter bestehen aus Elementen der 3. und 5. Hauptgruppe. Die Zusammensetzung der Elemente bestimmt die elektronische Bandlücke. Die Bandlücke ist der energetische Abstand zwischen Valenzband und Leitungsband. Werden III-V-Halbleiter postiv (p) und negativ (n) dotiert, also geringe Mengen der Atome werden gezielt durch andere Atome ersetzt, erhält man pn-Dioden für LEDs. LEDs (Leucht-Emitter-Dioden) wandeln elektrischen Strom in Licht um. Elektronen des n-dotierten Halbleiters und Löcher des p-dotierten Halbleiters rekombinieren am pn-Übergang und geben Licht ab. Die Wellenlänge des Lichtes entspricht der Energie der Bandlücke.
Beispiele für III-V-Halbleiter mit einer Bandlücke im sichtbaren Bereich:
| III-V-Halbleiter | Wellenlänge |
| GaAsP | 628 nm |
| AlGaInP | 588 nm |
| AlGaP | 528 nm |
| InGaN | 465 nm |
Flammenfärbung
Einige Elemente zeigen eine charakteristische Färbung der Flamme eines Brenners, wenn z. B. ihre Metallsalze in die Flamme gehalten werden. Dabei ist die Anwesentheit von Halogeniden z. B. durch HCl-Zusatz zur Bildung von Metallhalogeniden erforderlich. Durch homolytische Dissoziation der Metallhalogenide entstehen Metallradikale. Die Valenzelektronen des Metallradikals werden durch thermische Anregung des Brenners in einen höheren Zustand befördert und fallen schließlich wieder in ihren Grundzustand zurück. Beim Zurückfallen in den Grundzustand wird Licht emittiert. Die Wellenlänge des abgegebenen Lichtes wird bestimmt durch den energetischen Abstand zwischen angeregtem Zustand und Grundzustand, welcher für das Element charakteristisch ist.
Reaktionsgleichungen am Beispiel von Natrium (Na•* = angeregter Zustand):
NaCl → Na• + Cl•
Na• + ΔT → Na•*
Na•* → Na• + hν
Beispiele für Elemente mit einer Flammenfarbe im sichtbaren Bereich:
| Element | Flammenfärbung |
| Na | Gelb |
| K | Violett |
| Ca | Warmes Rot |
| Sr | Rotviolett |
| Ba | Grün |
| Cu | Blaue Flamme, grüner Saum |
Stirlingmotor
Im Stirlingmotor wird Wärmeenergie in mechanische Energie umgewandelt. Dies geschieht durch die periodische Erwärmung und Abkühlung des Arbeitgases z. B. Luft, welches in einem Kreisprozess durch die Temperaturveränderungen expandiert und komprimiert wird. Der Prozess kann in vier Stufen unterteilt werden:
1. Isochore Erwärmung: Die Luft wird im heißen Bereich erhitzt und dies führt zu deren Expansion.
2. Isotherme Expansion: Infolge der Ausdehnung presst der Verdängerkolben die heiße Luft in den kühleren Bereich.
3. Isochore Abkühlung: Die Luft kühlt ab und es entsteht ein Unterdruck.
4. Isotherme Kompression: Das Schwungrad drückt die kalte Luft vom Arbeitskolben wieder in den heißen Bereich und der Prozess beginnt von vorn.
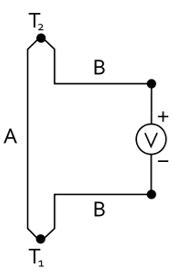
Thermogenerator
Im Thermogenerator wird thermische Energie in elektrische Energie umgewandelt. Dabei wird der Seebeck-Effekt genutzt, bei dem eine Temperaturdifferenz eine nutzbare Spannung verursacht, welche abhängig von der Materialkombination ist. Grund dafür ist die unterschiedliche Zustandsdichte und der dadurch hervorgerufenen Thermodiffusionsstrom. Dafür werden an den warmen Enden zwei Materialien elektrisch verbunbden und an den kalten Enden nicht. Als Materialien sind Halbleiter besonders geeignet z. B. Bi2Te3. Thermogeneratoren zeichnen sich durch einen geringen Wirkungsgrad von etwa 5 % aus und finden Anwendung als Temperaturmessfühler. Die Umkehrung des Seebeck-Effektes ist der Pelltier-Effekt zur Erzeugung einer Temperaturdifferenz durch ein Potential.